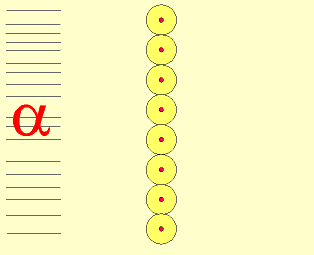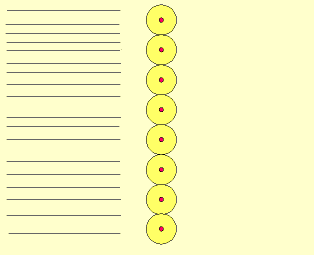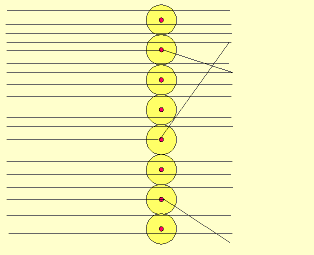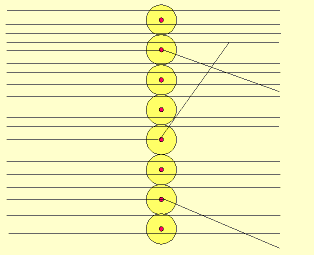Modelos Atômicos
- Modelo Atômico de Thomson (1898)
Com a descoberta dos prótons e elétrons, Thomson propôs um modelo de átomo no qual os elétrons e os prótons, estariam uniformemente distribuídos, garantindo o equilíbrio elétrico entre as cargas positiva dos prótons e negativa dos elétrons.

- Modelo Atômico de Rutherford (1911)
Rutherford bombardeou uma fina lâmina de ouro (0,0001 mm) com partículas "alfa" (núcleo de átomo de hélio: 2 prótons e 2 nêutrons), emitidas pelo "polônio" (Po), contido num bloco de chumbo (Pb), provido de uma abertura estreita, para dar passagem às partículas "alfa" por ele emitidas.
Envolvendo a lâmina de ouro (Au), foi colocada uma tela protetora revestida de sulfeto de zinco (ZnS).
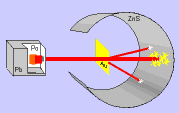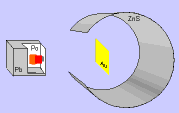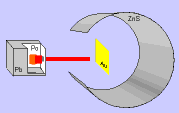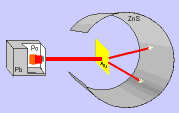
Observando as cintilações na tela de ZnS, Rutherford verificou que muitas partículas "alfa" atravessavam a lâmina de ouro, sem sofrerem desvio, e poucas partículas "alfa" sofriam desvio. Como as partículas "alfa" têm carga elétrica positiva, o desvio seria provocado por um choque com outra carga positiva, isto é, com o núcleo do átomo, constituído por prótons.
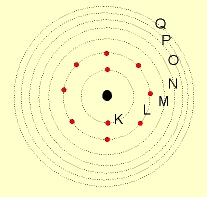
Assim, o átomo seria um imenso vazio, no qual o núcleo ocuparia uma pequena parte, enquanto que os elétrons o circundariam numa região negativa chamada de eletrosfera, modificando assim, o modelo atômico proposto por Thomson.

- Os Postulados de Niels Bohr (1885-1962)
De acordo com o modelo atômico proposto por Rutherford, os elétrons ao girarem ao redor do núcleo, com o tempo perderiam energia, e se chocariam com o mesmo.
Como o átomo é uma estrutura estável, Niels Bohr formulou uma teoria (1913) sobre o movimento dos elétrons, fundamentado na Teoria Quântica da Radiação (1900) de Max Planck.
A teoria de Bohr fundamenta-se nos seguintes postulados:
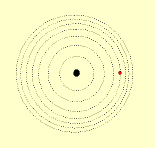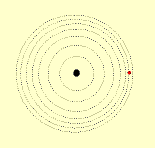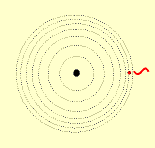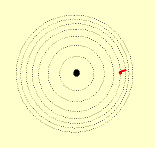
1º postulado: Os elétrons descrevem órbitas circulares estacionárias ao redor do núcleo, sem emitirem nem absorverem energia.
2º postulado: Fornecendo energia (elétrica, térmica, ....) a um átomo, um ou mais elétrons a absorvem e saltam para níveis mais afastados do núcleo. Ao voltarem as suas órbitas originais, devolvem a energia recebida em forma de luz (fenômeno observado, tomando como exemplo, uma barra de ferro aquecida ao rubro).
Teoria Quântica
De acordo com Max Planck (1900), quando uma partícula passa de uma situação de maior para outra de menor energia ou vice-versa, a energia é perdida ou recebida em "pacotes" que recebe o nome de quanta (quantum é o singular de quanta).
O quantum é o pacote fundamental de energia e é indivisível. Cada tipo de energia tem o seu quantum.
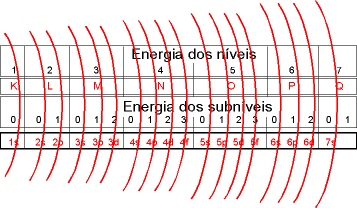
A Teoria Quântica permitiu a identificação dos elétrons de um determinado átomo, surgindo assim os "números quânticos".
- Modelo Atômico de Sommerfeld (1916)
Ao pesquisar o átomo, Sommerfeld concluiu que os elétrons de um mesmo nível, ocupam órbitas de trajetórias diferentes (circulares e elípticas) a que denominou de subníveis, que podem ser de quatro tipos: s , p , d , f .
- Contribuição de Broglie
Em 1923, Louis Broglie mostrou, através de uma equação matemática, que "qualquer corpo em movimento estaria associado a um fenômeno ondulatório". Desta maneira o elétron apresenta a natureza de uma partícula-onda, obedecendo assim, às leis dos fenômenos ondulatórios, como acontece com a luz e o som.
- Teoria da Mecânica Ondulatória
Em 1926, Erwin Shröringer formulou uma teoria chamada de "Teoria da Mecânica Ondulatória" que determinou o conceito de "orbital" .
Orbital é a região do espaço ao redor do núcleo onde existe a máxima probalidade de se encontrar o elétron.
O orbital s possui forma esférica ...................
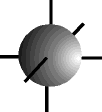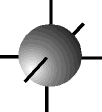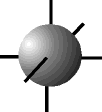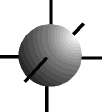
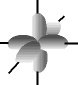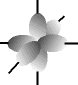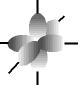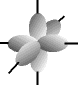
e os orbitais p possuem forma de halteres. ............