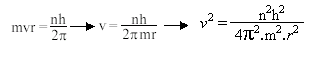O Modelo atômico de Dalton
Vários pensadores propuseram que a matéria seria constituída por átomos, assim como havia pensado Demócrito e Leucipo. Todavia, até a primeira metade do século XIX, esse modelo ainda não era aceito pela comunidade científica.
Em 1808, o cientista inglês John Dalton publicou um livro apresentando sua teoria sobre a constituição atômica da matéria. O seu trabalho foi amplamente debatido pela comunidade científica e, apesar de ter sido criticado pelos físicos famosos da época, a partir de segunda metade do século XIX os químicos começaram a se convencer, pela inúmeras evidências, de que tal modelo era bastante plausível.
O modelo de Dalton baseava-se nas seguintes hipóteses:
- Tudo que existe na natureza é composto por diminutas partículas denominadas átomos;
- Os átomos são indivisíveis e indestrutíveis;
- Existe um número pequeno de elementos químicos diferentes na natureza;
- Reunindo átomos iguais ou diferentes nas variadas proporções, podemos formar todas as matérias do universo conhecidos;
Para Dalton o átomo era um sistema contínuo.
Apesar de um modelo simples, Dalton deu um grande passo na elaboração de um modelo atômico, pois foi o que instigou na busca por algumas respostas e proposição de futuros modelos.
O Modelo de Thomson
O primeiro modelo detalhado do átomo, proposto por J. J. Thomson em 1898, baseava-se na ideia de que o átomo era uma esfera de eletricidade positiva, onde estavam submersas partículas negativas denominadas elétrons. Foi Thomson que lançou a ideia de que o átomo era um sistema descontínuo, portanto, divisível. Mas sua descrição não era satisfatória porque não permitia explicar as propriedades químicas do átomo.
Na verdade, Lord Thomson, estava mesmo era envolvido na descoberta do elétron onde deu sua maior contribuição. Por se tratar de uma pessoa de alta influência na época, Thomson tratou de propor alguma explicação para o átomo. Seu modelo conhecido como pudim de ameixa, já que o átomo seria uma massa compacta com cargas alternadas em seu interior, foi muito infeliz mesmo para sua época e não teve muita contribuição como modelo atômico propriamente.
Modelo atômico de Rutherford
No final do século XIX, o físico neozolandês Ernest Rutherford foi convencido por J.J. Thomson a trabalhar com o fenômeno então recentemente descoberto: a radioatividade.. seu trabalho permitiu a elaboração de um modelo atômico que possibilitou o entendimento da radiação emitida pelos átomos de urânio, rádio e polônio.
Aos 26 anos de idade, Rutherford fez sua maior descoberta. Estudando a emissão de radiação do urânio e do tória, observou que existem dois tipos distintos de radiação: uma que é rapidamente absorvida, que denominamos de radiação alfa, e outra com maior poder de penetração, que denominamos radiação beta.
Ele descobriu que a radiação alfa é atraída pelo polo negativo, enquanto a beta é atraída pelo positivo de um campo elétrico. Em seus estudos, foi mostrado que as partículas alfa são iguais à átomos de hélio sem os elétrons, e que o baixo poder de penetração se deve à sua elevada massa. Rutherford descobriu também que a radiação beta é constituída por partículas negativas que possuem massa igual a dos elétrons e um poder de penetração maior do que a radiação alfa.
Em 1909, o aluno de doutorado em física Johannes Hans Wilhelm Geiger (1882-1945) e o professor inglês Ernest Marsden (1889-1970), sob orientação de Rutherford, trabalharam em um aparato experimental que possibilitava a observação da trajetória das partículas alfa. Diversoso experimentos foram desenvolvidos por Geiger, Marsden e Rutherford, utilizando esse equipamento, e os resultados foram espantosos.
O experimento de Rutherford
Um dos experimentos conduzidos pela equipe de Rutherford revolucionou o modo como os físicos da época passaram a imaginar o átomo. Foram bombardeadas finas lâminas de ouro, para estudo de deflexões (desvios) de partículas alfa.
De acordo com o modelo de Thomson, esses desvios seriam improváveis, pois sendo as partículas alfa muito mais leves do que os átomos da lâmina de ouro, os elétrons teriam tanto dificuldade para desviar suas trajetórias quanto bolas de gude para desviar balas de canhão.
Para perceber possíveis desvios, utilizou-se uma placa de material fosforescente que emite luz quando colidida pela radiação alfa. Dessa maneira, ao colocar uma fina lâmina de ouro entre a chapa fosforescente e o material radioativo, a luminosidade na chapa deveria cessar, pois a lâmina de ouro bloquearia a passagem da radiação.
Para surpresa de Rutherford, uma grande luminosidade continuou aparecendo do outro lado da lâmina de ouro, indicando que a radiação alfa havia atravessado sem a menor dificuldade. Além disso, ele observou o surgimento de uma pequena luminosidade em outras partes da chapa. Isso evidenciava que a trajetória de uma parte da radiação alfa era desviada por algo na lâmina de ouro.
Com bases nas suas observações foi possível notar que existiriam espaços vazios entre os átomos, por onde estava passando a radiação.
Um novo modelo
Através de vários testes, Rutherford e sua equipe conseguiram estabelecer um novo modelo de átomo, que ocuparia um volume esférico e que possuía um núcleo. Estabeleceu que o núcleo contém a maior parte da massa do átomo e possui carga positiva (responsável pelos poucos desvios da radiação alfa). A região externa ao núcleo está ocupada pelos elétrons numa região denominada eletrosfera ou coroa eletrônica. Os elétrons estariam em movimento em torno do núcleo, na eletrosfera.
O átomo é um sistema neutro, ou seja, o número de cargas positivas e negativas é igual. O átomo é um sistema descontínuo onde prevalecem os espaços vazios.
Modelo atômico de Bohr
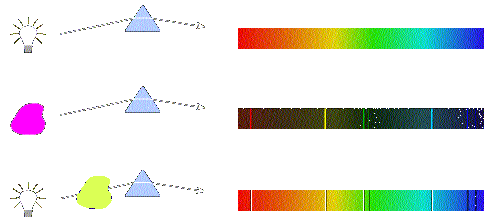
Quando átomos são aquecidos ou submetidos a uma descarga elétrica, eles absorvem energia, que em seguida é emitida como radiação. Por exemplo, se o cloreto de sódio é aquecido na chama de Bunsen, serão produzidos átomos de sódio, que dão origem a uma coloração amarela característica na chama, produzindo linhas espectrais descontínuas em aparelhos específicos. Essa luz emitida pelos átomos podem ser estudadas em espectrômetros, verificando-se que elas são constituídas por linhas com diferentes comprimentos de onda.
O matemático Rydberg, propôs uma equação empírica relacionada às linhas espectrais:
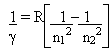
onde R é um valor constante determinado por Rydberg, chamada de constante de Rydberg.
É somente válida para o espectro do hidrogênio a equação acima.
Na época que Rutherford publicou seu modelo já existiam conceitos físicos consagrados e um destes conceitos era a Lei do Eletromagnetismo de Maxwell que dizia: "Toda carga elétrica em movimento acelerado em torno de outra perde energia sob forma de ondas eletromagnéticas". Como o elétron é uma carga elétrica em movimento acelerado em torno do núcleo, perderia energia e se aproximaria do núcleo até chocar-se com este; desta forma o átomo se auto-destruiria.
Em 1913 Bohr afirmou que os fenômenos atômicos não poderiam ser explicados pelas Leis da Física Clássica.
Niels Bohr, dinamarquês, contribuiu para o aperfeiçoamento do modelo atômico de Rutherford. Baseado na teoria quântica, Bohr explicou o comportamento dos elétrons nos átomos. Para Bohr, os elétrons giram em torno do núcleo de forma circular e com diferentes níveis de energia. Seus postulados:
- O átomo possui um núcleo positivo que está rodeado por cargas negativas;
- A eletrosfera está dividida em camadas ou níveis eletrônicos, e os elétrons nessas camadas, apresentam energia constante;
- Em sua camada de origem (camada estacionária) a energia é constante, mas o elétron pode saltar para uma camada mais externa, sendo que, para tal é necessário que ele ganhe energia externa;
- Um elétron que saltou para uma camada de maior energia fica instável e tende a voltar a sua camada de origem; nesta volta ele devolve a mesma quantidade de energia que havia ganho para o salto e emite um fóton de luz.
A energia recebida corresponde a um quantum e é dada por q = h x f
q = energia do quantum h = constante de Planck f = frequência da radiação
- Para que um elétron permaneça em sua órbita, a atração eletrostática entre o núcleo e o elétron, que tende a puxar o elétron em direção ao núcleo dever ser igual a força centrífuga, que tende a afastar o elétron. Para um elétron de massa m, movendo-se com uma velocidade v numa órbita de raio r, temos que:
![]() (fórmula da física clássica)
(fórmula da física clássica)
Se e for a carga do elétron, Z a carga do núcleo e ε0a permissividade no vácuo, então:
De modo que
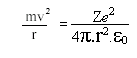
E portanto
![]() *
*
De acordo com a teoria quântica de Planck, a energia não é contínua, mas discreta (pacotes de energia). isso significa que a energia de um elétron numa órbita, isto é, seu momento angular mvr, deve ser igual a um número inteiro n de quanta.
Combinando-se essa equação, com a equação *, temos que
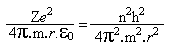
e portanto
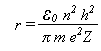
Substituindo o valor das constantes, temos r = 5,292x10-11m, para n = 1. Assim, variando valor de n, teremos uma imagem do átomo de hidrogênio em que o elétron se move em órbitas circulares. O átomo emitirá ou absorverá energia somente ao passar de uma órbita para outra.
Com um pouco de habilidade e paciência, rearranjamos as fórmulas acima e temos:
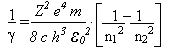
Ou seja, Bohr conseguir obter a empírica equação de Rydberg através de conceitos clássicos e quânticos ao mesmo tempo, onde a constante R de Rydberg é
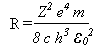
O valor experimental de R é 1,097373x107m-1 em boa concordância com o valor teórico de 1,096776x107m-1. A teoria de Bohr fornece uma explicação para o espectro do hidrogênio. As diferentes séries de linhas espectrais podem ser obtidas variando os valores de n12 e n22 na equação acima.
Modelo de Sommerfeld:
Logo após Bohr enunciar seu modelo verificou-se que um elétron, numa mesma camada, apresentava energias diferentes. Como poderia ser possível se as órbitas fossem circulares?
Sommerfild sugeriu que as órbitas fossem elípticas, pois em uma elipse há diferentes excentricidades (distância do centro), gerando energias diferentes para uma mesma camada.
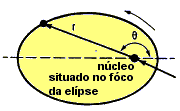 |
| O elétron descreve órbita elíptica, de acordo com Sommerfeld. |
Modelo atômico atual
O modelo proposto por Bohr trouxe um avanço ao considerar níveis quantizados de energia, mas ainda apresentava inúmeros problemas. Muita coisa permanecia sem explicação ou era simplesmente colocado guela abaixo.
O modelo atômico atual é um modelo matemático- probabilístico que se baseia em dois princípios:
- Princípio da Incerteza de Heisenberg: é impossível determinar com precisão a posição e a velocidade de um elétron num mesmo instante.
- Princípio da Dualidade da matéria de Louis de Broglie: o elétron apresenta característica DUAL, ou seja, comporta-se como matéria e energia sendo uma partícula-onda.
O Princípio da Incerteza deixa clara a impossibilidade de determinar a exata trajetória do elétron a partir da energia e da velocidade. Por este motivo, buscou-se, então, trabalhar com a provável região onde é possível encontrá-lo.
Erwin Schröndinger (1887 - 1961) baseado nestes dois princípios criou o conceito de Orbital.
Orbital é a região onde é mais provável encontrar um életron.
Dirac calculou estas regiões de probabilidade e determinou os quatro números quânticos, que são: principal, secundário, magnético e de spin.
Número quântico principal (n): este número quântico localiza o elétron em seu nível de energia. Ele assume valores que vão de 1 até o infinito, mas para os átomos conhecidos atualmente com, no máximo, 7 camadas teremos uma variação de 1 até 7.
n = 1, 2, 3, 4, 5, 6, 7
| Nível | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Camada | K | L | M | N | O | P | Q |
Número quântico secundário (l): localiza o elétron no seu subnível de energia e dá o formato do orbital. Pode assumir valores que vão desde ZERO até n - 1. Para átomos conhecidos:
l = 0, 1, 2, 3, 4, 5, 6
Cada valor de nível "l" indica a presença de um subnível. Os subníveis são representados pelas letras minúsculas s, p, d, f, g, h, i, etc...
| valor de "l" | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| subnível | s | p | d | f | g | h | i |
Obs.: a simbologia correta para o n° quântico secundário é uma letra "L" minúscula (l)
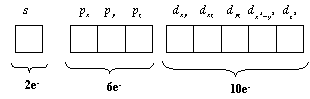
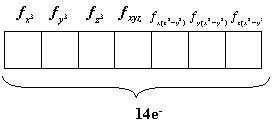
Sempre existirá, para cada nível: 1 orbital s, 3 orbitais p e 5 orbitais d e 7 orbitais f. Como cada um destes podem comportar até 2 elétrons pode-se esperar que o número de elétrons que estes orbitais podem acomodar é:
Formato dos Orbitais
| subnível s | 1 orbital s - uma única orientação |
| subnível p | 3 orbitais p - 3 orientações: px;py;pz |
| subnível d | 5 orbitais d - 5 orientações: dxy;dxz;dyz;dx2y2 e dz2 |
| subnível f | 7 orbitais f - 7 orientações |
Obs.: Clique sobre as orientações para visualizar o formato do orbital. Como as ligações no orbital "f" tem menor importância, além de serem mais complicadas, não disponibilizamos as visualizações das orientações.
Importante lembrar que os átomos terão um certo conjunto de orbitais atômicos independentemente de possuir elétrons ou não, em outras palavras, um orbital atômico não deixa de existir só porque ele está vazio.
Quando tratamos de orbitais do mesmo tipo, por exemplo, orbitais p, podemos dizer que estes são totalmente equivalente, no que se refere a energia, não havendo qualquer distinção entre eles, exceto por sua orientação espacial, ou seja, em que posição no espaço ele se encontra, neste exemplo existem três orientações distintas, a vertical, a horizontal e a perpendicular ao plano formado pelos dois anteriores.
Em relação aos níveis de energia temos o seguinte:
1° Nível --> existe apenas o orbital atômico s
2° Nível --> existem os orbitais s e p
3° Nível --> existem os orbitais s, p e d
4° Nível --> existem os orbitais s, p, d e f
5° Nível --> existem os orbitais s, p, d, f e g
6° Nível --> existem os orbitais s, p, d, f, g e h
7° Nível --> existem os orbitais s, p, d, f, g, h e i
Normalmente não são representados os orbitais g, h e i, visto que não existe nenhum elemento químico conhecido que tenha um número de elétrons suficientes para preenchê-los. Podemos então citar, neste momento, como se executa a distribuição eletrônica de um determinado átomo.
Para se proceder a distribuição eletrônica de um elemento químico é necessário conhecer seu número atômico (Z) que corresponde ao número de prótons no seu núcleo. Desta forma, se o elemento estiver eletricamente neutro, conclui-se que o número de elétrons é igual ao número de prótons. Caso o elemento químico tiver cargas positivas, significa que o número de elétrons deste átomo será o número Z menos o número de cargas, por outro lado, se a carga elétrica do elemento for negativa, então o número de elétrons que ele possui será o número Z mais a sua(s) carga(s).
Para se fazer uma distribuição eletrônica é importante lembrar que os elétrons de uma espécie química não podem ficar espalhados aleatoriamente, em qualquer lugar em torno do núcleo. Os elétrons só podem ficar nas regiões que forem efetivamente definidas pelos orbitais. Assim, como cada átomo apresenta um certo número de orbitais atômicos, deve haver uma sequência definida de preenchimento destes orbitais pelos elétrons do elemento. Essa ordem obedece uma ordem crescente de energia, ou seja, os orbitais que tiverem uma energia menor, deverão ser preenchidos primeiro. A ordem de preenchimento dos orbitais é definida segundo um diagrama conhecido por diagrama de Linus Pauling, mostrado abaixo:
Número quântico magnético(M): Localiza o elétron no orbital e dá a orientação espacial dos orbitais. O número quântico magnético pode assumir valores que vão desde - l até + l, passando pelo zero.
M = - l,....0,....+l
Sendo l = n° quântico secundário
Se l = 0, então M = 0
l = 1, então M = -1, 0, +1
Se l = 2, então M = -2, -1, 0, +1, +2
| Valores de l | subnível | valores de M | n° orbitais/orientações |
| 0 | s | 0 | 1 |
| 1 | p | -1, 0, +1 | 3 |
| 2 | d | -2,-1,0,+1,+2 | 5 |
| 3 | f | -3,-2,-1,0,+1,+2,+3 | 7 |
Número quântico de Spin (S): este número está relacionado com o movimento de rotação do elétron em um orbital. Como este movimento admite apenas dois sentidos, o n° quântico de spin, assume dois valores que são, por convenção:
S = -1/2 e +1/2
Por convenção, também, utiliza-se spin -1/2 para o primeiro elétron do orbital.
Lembre-se que a expressão "rotação", aqui utilizada, nos dá uma ideia do elétron apenas como partícula, só que ele tem comportamento dual de partícula-onda. Na falta de um termo mais apropriado vamos utilizar esta expressão, mas sem esquecer que o elétron não é apenas partícula.
Princípio da exclusão de Wolfgang Pauli
Em um mesmo átomo, não existem dois elétrons com quatro números quânticos iguais.
Como consequência desse princípio, dois elétrons de um mesmo orbital têm spins opostos.
Um orbital semicheio contém um elétron desemparelhado; um orbital cheio contém dois elétrons emparelhados (de spins opostos).
Regra de Hund
Ao ser preenchido um subnível, cada orbital desse subnível recebe inicialmente apenas um elétron; somente depois de o último orbital desse subnível ter recebido seu primeiro elétron começa o preenchimento de cada orbital semicheio com o segundo elétron.
Elétron de maior energia ou elétron de diferenciação é o último elétron distribuído no preenchimento da eletrosfera, de acordo com as regras estudadas.
É importante salientar que os números quânticos são, na verdade, uma aproximação para as complexas equações propostas por Schrödinger.
Equação de Schrödinger
Esta equação representa a equação de Schrödinger independente do tempo e unidimensional da função de onda a qual descreve a propriedade de onda da partícula de massa m. Em três dimensões temos:
![]()
Onde:
H . Operador hamiltoniano
ψ . Função de onda de um corpo no espaço (três coordenadas: x, y e z)
A função de onde ψ deve satisfazer certas condições:
1 - Deve apresentar um valor único, contínuo e diferencial em todos os pontos do espaço;
2 - Deve ser finita para todos os valores de x, y e z;
3 - Deve ser normalizada. Isto significa que ![]() , ou seja, a integral do quadrado da função de onda sobre todo espaço deve ser igual a 1.
, ou seja, a integral do quadrado da função de onda sobre todo espaço deve ser igual a 1.
ψ não tem uma interpretação física, pois não apresenta necessariamente valores reais, pode ser uma função complexa, porém, o quadrado de um número complexo se define como o produto dele pelo seu conjugado: |a + ib|2 = (a +ib).(a - ib) = a2 + b2 (sempre real), sendo assim, |ψ|2 (ou ψψ*) calculado para um ponto particular em um instante particular é proporcional à probabilidade de encontrar experimentalmente o corpo naquele lugar e naquele instante.
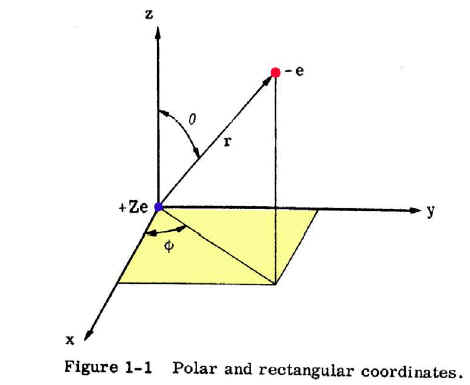
O objeto modelo que representa um átomo de hidrogênio consiste de um núcleo, de massa M e carga Ze e um elétron, com massa me e carga -e, separados por uma distância r. Ambas partículas se consideram como cargas pontuais, portanto a equação de Schrödinger será:
Nesta equação, ψ é função de seis coordenadas, ou seja, xN, yN e zN (coordenadas no núcleo) e xe, ye e ze (coordenadas do elétron).
Schrödinger mostrou que a mudança destas seis coordenadas por um conjunto adequado de outras seis coordenadas, conduz a separação da equação acima em duas partes: uma expressa e determina o movimento translação do átomo e a outra, fundamentalmente eletrônica, que descreve o movimento relativo do elétron respeito ao núcleo, ou seja, a função de onda ψ pode ser expressa como o produto da função ψN, que depende das coordenadas do centro de massa do átomo (X, Y e Z) respeito a uma origem arbitrária e por uma função ψ, eletrônica, das coordenadas relativas do elétron (x, y e z) como mostra a figura a seguir:
A tabela abaixo mostra alguns valores da função radial do átomo de hidrogênio:
Direitos autorais: Prof. J. D. Ayala
Fonte: