Descoberta do elétron (Joseph John Thomson)
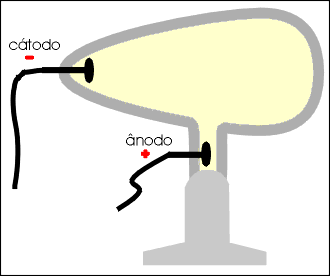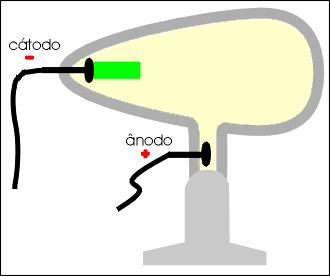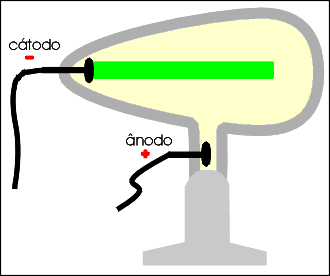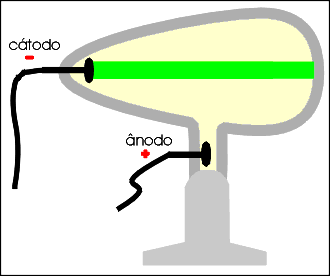
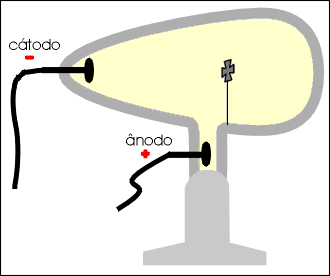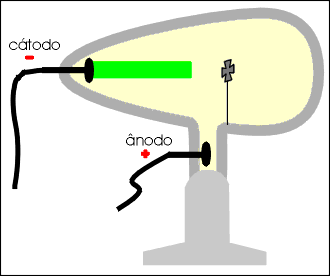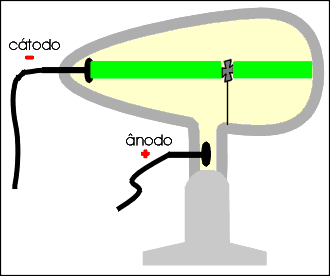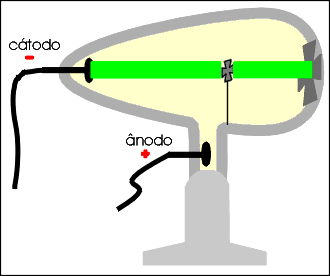
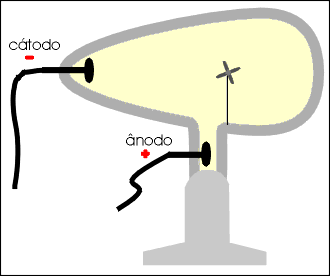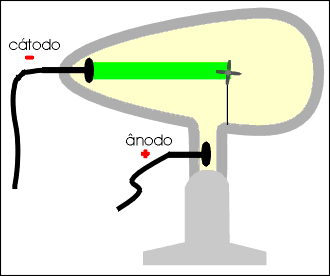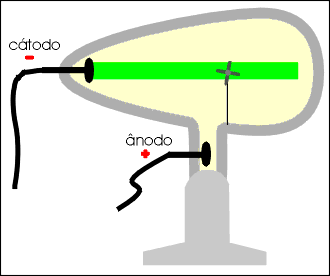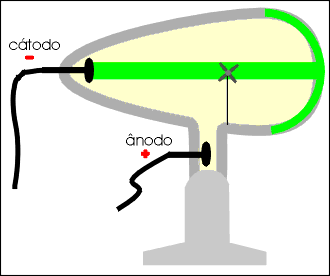
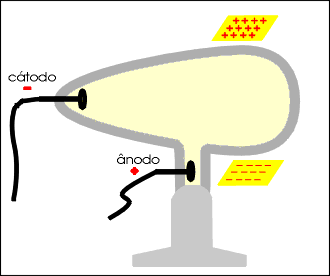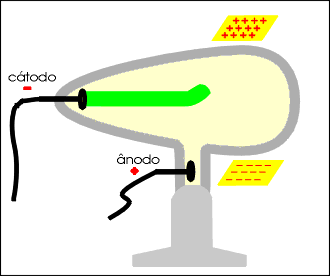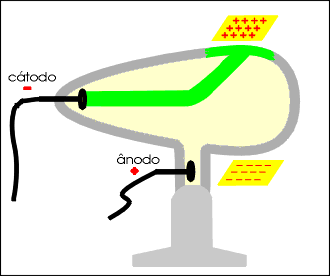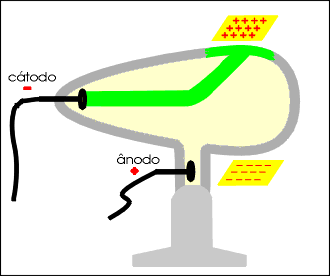
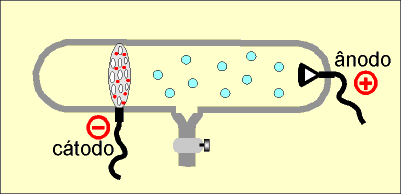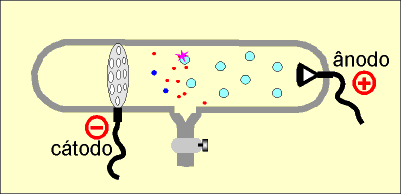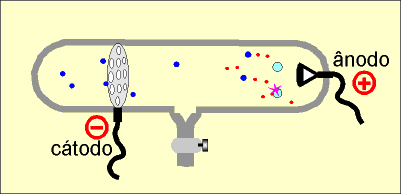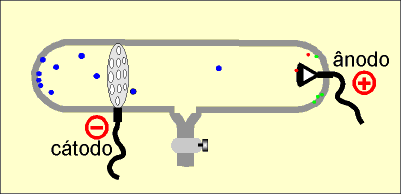
Num tubo de vidro denominado de Ampola de Crookes (*) são colocados dois eletrodos: o cátodo (polo negativo) e o ânodo (polo positivo).
No interior do tubo existe gás rarefeito submetido a uma descarga elétrica superior a 10 000 volts. Do cátodo parte um fluxo de elétrons denominado raios catódicos, que se dirige à parede oposta do tubo, produzindo uma fluorescência decorrente do choque dos elétrons que partiram do cátodo com os átomos do vidro da ampola.
Os raios catódicos, quando incidem sobre um anteparo, produzem uma sombra na parede oposta do tubo, permitindo concluir que se propagam em linha reta.
Os raios catódicos movimentam um molinete ou catavento de mica, permitindo concluir que são dotados de massa.
Os raios catódicos são desviados por um campo de carga elétrica positiva, permitindo concluir que são dotados de carga elétrica negativa.
Sendo os raios catódicos um fluxo de elétrons, podemos concluir finalmente que:
- os elétrons se propagam em linha reta,
- os elétrons possuem massa (são corpusculares) e
- os elétrons possuem carga elétrica de natureza negativa.
Thonsom demonstrou que, qualquer que seja o gás rarefeito contido no tubo, o comportamento do fluxo luminoso é o mesmo, permitindo concluir que os elétrons ou raios catódicos são iguais para todos os átomos.
(*) O inglês William Crookes, a partir de 1878, fez experiências sobre a descarga elétrica através de gases rarefeitos.
Descoberta do próton (Eugen Goldstein)
No interior da ampola de descarga em gases rarefeitos é colocado um cátodo perfurado.
Do cátodo perfurado partem os elétrons ou raios catódicos (representados em vermelho), que se chocam com as moléculas do gás (em azul claro) contido no interior do tubo. Com o choque, as moléculas do gás perdem um ou mais elétrons, originando íons positivos (em azul escuro) que repelidos pelo ânodo, são atraídos pelo cátodo, atravessam os furos e colidem com a parede do tubo de vidro, enquanto os elétrons são atraídos pelo ânodo e ao colidirem com a parede de vidro do tubo produzem fluorescência.
Os raios canais são, na realidade, prótons.
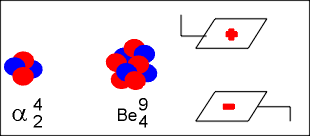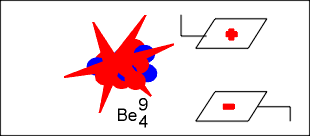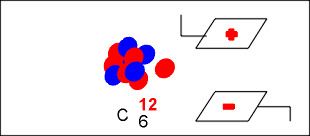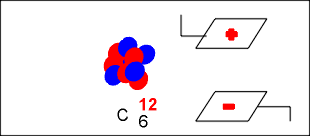
A massa dos raios canais varia de acordo com o gás rarefeito. Assim, quando o gás é o hidrogênio, os raios canais são íons positivos de menor carga e massa, permitindo concluir que a massa dos raios canais depende do tipo do gás rarefeito, contido na ampola. Descoberta do nêutron (Chadwick) Num acelerador de partículas subatômicas, a partícula alfa , que é o núlceo do átomo de hélio, com dois prótons e dois nêutrons e número de massa quatro (4), é lançada contra o núcleo do átomo de berílio, com quatro prótons e cinco nêutrons e número de massa nove (9).
Na colisão o átomo de berílio adiciona a partícula alfa e transmuta-se no elemento químico carbono, com seis prótons e sete nêutrons, número de massa treze (13) e que por ser instável, elimina um nêutrons e transmuta-se no carbono estável de número de massa doze (12).
O nêutron eliminado, ao atravessar um campo elétrico, não sofre desvio, permitindo concluir que o nêutron é uma partícula que não possui carga elétrica, mas que possui massa praticamente igual a do próton.