Sólidos e líquidos resistem a esforços de tração (ilustração abaixo, à esquerda); este fato da experiência revela forças de atração entre os corpúsculos (átomos ou moléculas) que compõem o corpo ensaiado; mesmo em gases e vapores, existem débeis forças de atração entre os corpúsculos (efeito Joule -Thompson). Tais forças de atração exercidas entre corpúsculos da mesma espécie química são denominadas forças de coesão.
Esforços de tração crescentes aplicados a um corpo alongam-no até rompe-lo; isto demonstra que as forças de coesão diminuem rapidamente à medida que aumenta a distância entre os corpúsculos.
Forças de atração entre corpúsculos de espécies químicas diferentes são denominadas forças de adesão.
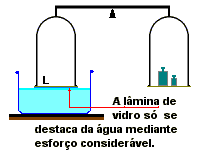
Por exemplo, a água adere fortemente a uma superfície de vidro perfeitamente desengordurada. Na experiência ilustrada acima, à direita, uma carga suficientemente grande no prato à direita determina o levantamento da lamina de vidro; a inspeção desta revela estar molhada a face inferior. Portanto, o levantamento do vidro se dá com superação das forças de coesão, sem vencer as de adesão; assim constatamos que a adesão entre a água e o vidro é mais intensa do que a coesão da água.
Cola e madeira, solda de estanho e fios de cobre, são exemplos de substâncias entre as quais se desenvolvem forças de adesão consideráveis.
A esforços de compressão a matéria resiste indefinidamente, portanto desenvolvem-se entre os corpúsculos forças crescentes de repulsão quando eles são aproximados mais e mais. As forças exercidas entre as moléculas são denominadas forças de Van der Waals.
|
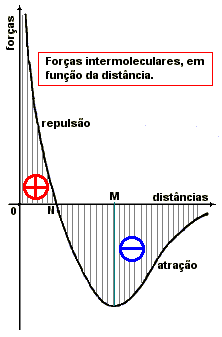
Do exposto depreende-se que as forças de Van der Waals variam em função da distância que separa as partículas da maneira representada no gráfico ao lado. |
Dado um corpúsculo X, denomina-se esfera de ação molecular a esfera de centro X e raio OZ. O corpúsculo X aplica forças sobre todos os demais corpúsculos situados dentro da esfera de ação, e sofre as correspondentes reações. Entre o corpúsculo X e os corpúsculos fora de sua esfera de ação as forças despertadas são desprezíveis. O raio de ação molecular é da ordem de 15x10-8 cm (Quincke).