Um importante passo no desenvolvimento das concepções sobre a natureza da luz foi dado no estudo de um fenômeno muito interessante, descoberto por H. Hertz . Este fenômeno recebeu o nome de efeito fotoelétrico.
O efeito fotoelétrico consiste na emissão de elétrons pela matéria sob a ação da luz.
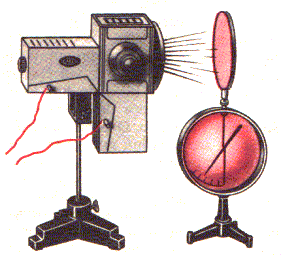
Para se observar o efeito fotoelétrico , é conveniente utilizar um eletroscópio de folhas ( fig. 1). No eletroscópio monta-se uma lâmina de zinco. Se a lâmina estiver carregada positivamente, a sua iluminação, por exemplo com a ajuda de um arco voltaico, não influi na velocidade de descarga do eletroscópio. No entanto, se a lâmina estiver carregada negativamente, o feixe de luz do arco descarrega o eletroscópio com grande rapidez.
Este fato só pode ser explicado de uma maneira. A luz provoca a emissão de elétrons pela superfície da lâmina. Quando a lâmina está carregada negativamente, repele os elétrons e o eletroscópio descarrega-se. Quanto está carregada positivamente, os elétrons emitidos sob a ação da luz são atraídos e voltam ao eletroscópio. É por esta razão que a carga do eletroscópio não varia.
Fig. 1
No entanto, quando o feixe de luz é interceptado por um vidro normal, a lâmina carregada deixa de perder elétrons, independentemente da intensidade do feixe de luz. Como é conhecido que o vidro absorve os raios ultravioletas, pode concluir-se que é precisamente a parte ultravioleta do espectro que provoca o efeito fotoelétrico. Este fato, apesar de simples, não pode ser explicado com base na teoria ondulatória da luz. Não se compreende porque é que as ondas de luz de pequena frequência não provocam a emissão de elétrons mesmo nos casos em que a amplitude da onda, e, portanto, a força com que ela atua nos elétrons, são grandes.
Leis do efeito fotoelétrico
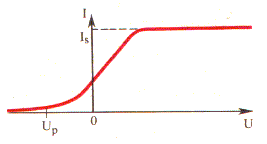
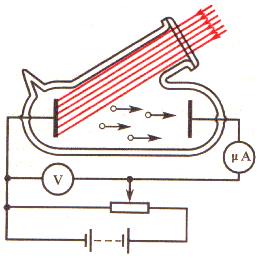
Para se obter uma ideia mais completa sobre o efeito fotoelétrico é necessário determinar de que é que depende o número de elétrons ( foto elétrons ) emitidos, sob a ação da luz, por uma superfície e a velocidade ou energia cinética desses elétrons. Com este objetivo foram levadas a cabo investigações experimentais, que passamos a descrever. Colocam-se dois eléctrodos num balão de vidro do qual se retirou previamente o ar ( fig. 2). Num dos eléctrodos, através de uma "janela" de quartzo, transparente não só para a luz visível como também para a radiação ultravioleta, incidem os raios de luz. Com a ajuda de um potenciômetro faz-se variar a diferença de potencial entre os eléctrodos, medindo-a por meio de um voltímetro. O polo negativo da pilha liga-se ao eléctrodo iluminado. Sob a ação da luz, este eléctrodo emite elétrons que, ao movimentarem-se no campo elétrico, criam corrente elétrica. Quando o potencial é pequeno, nem todos os elétrons atingem o outro eléctrodo. Se se aumentar a diferença de potencial entre os eléctrodos e não se alterar o feixe de luz, a intensidade da corrente aumenta, atinge o valor máximo, depois do que deixa de crescer ( fig. 3). O valor máximo da intensidade da corrente Is chama-se corrente de saturação. A corrente de saturação é determinada pelo número de elétrons emitidos num segundo pelo eletrodo iluminado.
Mudando, nesta experiência, o feixe luminoso, determinou-se que o número de elétrons emitidos pela superfície do metal num segundo é diretamente proporcional à energia da onda de luz, absorvida durante o mesmo intervalo de tempo. Neste fato não há nada de inesperado, já que quanto maior é a energia do feixe de luz, mais eficaz se torna a sua ação.
Passemos agora à medição da energia cinético ( ou velocidade) dos elétrons. No gráfico da fig. 3, vê-se que a intensidade da corrente fotoelétrica é diferente de zero mesmo quando a diferença de potencial é nula. Isto significa que, mesmo na ausência de diferença de potencial, uma parte dos elétrons atinge o eléctrodo direto ( fig. 2). Se se alterar a polaridade da bateria, a intensidade da corrente diminui até se anular, quando o potencial de polaridade inversa atinge o valor Up . Isto significa que os elétrons emitidos são detidos e forçados a valor para trás, sob a ação do campo elétrico.
O potencial de paragem Up depende do valor máximo da energia cinética que os elétrons emitidos atingem sob a ação da luz. A medição do potencial de paragem e o teorema da energia cinética permitem calcular energia cinética máxima dos elétrons:
![]()
Verificou-se experimentalmente que o potencial de paragem não depende da intensidade da luz ( energia transmitida ao eléctrodo por unidade de tempo). Não muda, portanto, também a energia cinética dos elétrons. Do ponto de vista da teoria ondulatória, este fato é incompreensível já que, quanto maior for a intensidade da luz, maiores são as forças que se exercem sobre os elétrons por parte do campo electromagnético da onda luminosa e, portanto, mais energia deveria ser transmitida aos elétrons.
Verificou-se experimentalmente que a energia cinética dos elétrons emitidos sob a ação da luz só depende da frequência da luz. A energia cinética máxima dos fotoelétrons é proporcional à frequência da luz e não depende da intensidade desta. O efeito fotoelétrico não se verifica quando a frequência da luz é menor do que um dado valor mínimo vmin , dependente do material do eléctrodo.
Teoria do Efeito Fotoelétrico
Não resultou nenhuma das tentativas, feitas no sentido de explicar o efeito fotoelétrico com base nas leis de Maxwell ( segundo as quais a luz é uma onda electromagnética distribuída continuamente no espaço). Era impossível compreender porque é que a energia dos elétrons fotoelétricos é determinada apenas pela frequência da luz, nem perceber a causa pela qual só quando o comprimento de onda é pequeno a luz se torna capaz de arrancar elétrons.
O esclarecimento do efeito fotoelétrico foi dado em 1905 por Alberto Einstein que desenvolveu a ideia de Planck sobre a emissão intermitente de luz. Nas leis experimentais do efeito fotoelétrico, Einstein viu uma prova evidente de que a luz tem uma estrutura intermitente e é absorvida em porções independentes. A energia E de cada uma das porções de emissão, de acordo com a hipótese de Planck, é proporcional à frequência.
E = hf , onde h é a constante de Planck. ( 1 )
O fato de, como provou Planck, a luz ser emitida em porções, ainda não constitui uma confirmação definitiva do caráter descontínuo da estrutura da própria luz. Repara-se que a chuva também cai na terra sob a forma de gotas, o que não quer dizer que a água nos rios e lagos seja constituída por gotas, isto é, quantidades pequenas independentes. Apenas o efeito fotoelétrico permite pôr em evidência a estrutura descontínua da luz: a porção de energia luminosa E = hv contínua a manter a sua integridade, de tal modo, que essa dada porção de luz, quando é absorvida, tem de absorver-se toda de uma vez. A energia E de cada uma das porções de emissão é dada pela fórmula ( 1).
A energia cinética do elétron fotoelétrico pode ser calculada aplicando a lei da conservação de energia. A energia de uma porção de luz , hf permite realizar o trabalho de arranque W, isto é, o trabalho indispensável para arrancar um elétron do seio do metal e comunicar-lhe uma certa energia cinética. Por conseguinte,
![]() ( 2 )
( 2 )
Esta equação permite esclarecer todos os fatos fundamentais relacionados com o efeito fotoelétrico. A intensidade da luz, segundo Einstein, é proporcional ao número de quantos (porções) de energia contido no feixe luminoso e, por conseguinte, determina o número de elétrons arrancados da superfície metálica. A velocidade dos elétrons, conforme ( 2) , é dada apenas pela frequência da luz e pelo trabalho de arranque, que depende da natureza do metal e da qualidade da sua superfície. Atenda-se a que a velocidade dos elétrons não depende da intensidade da luz.
Para uma dada substância, o efeito fotoelétrico pode observar-se apenas no caso de a frequência f da luz ser superior ao valor mínimo f min . Convém reparar que para se poder arrancar um elétron do metal, mesmo sem lhe comunicar energia cinética, há que realizar o trabalho de arranque W. Portanto, a energia de um quanto ( quantum) deve ser superior a este trabalho:
hf > W
A frequência limite f min tem o nome de limite vermelho do efeito fotoelétrico e calcula-se pela seguinte fórmula:
![]()
O trabalho de arranque W depende da natureza da substância. Portanto, a frequência limite f min do efeito fotoelétrico ( dito limite vermelho) varia de substância para substância.
Por exemplo, ao limite vermelho do zinco corresponde o comprimento de onda l max = 3,7 . 10-7 m ( radiação ultravioleta). É precisamente por isso se explica o fato de efeito fotoelétrico cessar quando se interpõe uma lâmina de vidro, capaz de deter raios ultravioletas.
O trabalho de arranque no alumínio ou no ferro é maior do que no zinco, razão por que na experiência de 1 se utilizou uma lâmina de zinco. Nos metais alcalinos, pelo contrário, o trabalho de arranque é menor, ao passo que o comprimento de onda l max correspondente ao limite vermelho é maior. Assim, por exemplo, relativamente ao sódio verifica-se l max = 6,8 . 10-7 m.
Através da equação de Einstein (2) é possível calcular a constante de Planck h. Para tal há que determinar experimentalmente a frequência v da luz, o trabalho de arranque W e avaliar a energia cinética dos elétrons fotoelétricos. Avaliações e cálculos apropriados mostram que h = 6,63 x 10-34 J.s. O mesmo valor numérico foi obtido por Planck durante o estudo teórico de outro fenômeno diferente que é a radiação térmica. O fato de terem coincidido os valores da constante de Planck obtidos por métodos diferentes, confirma a certeza da hipótese acerca do caráter descontínuo da emissão e absorção da luz pelas substâncias