A composição espectral da irradiação de diferentes substâncias é muito diversa. Mas, apesar disso, todos os espectros, como se viu experimentalmente, podem dividir-se em três tipos que se distinguem fortemente uns dos outros.
Espectros contínuos
O espectro solar ou o espectro de qualquer lanterna de arco é contínuo. Isto significa que no espectro se encontram todos os comprimentos de onda. No espectro não há rupturas e no écran do espectrógrafo pode ver-se uma risca contínua multicolor.
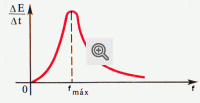
A distribuição da energia segundo a frequência ( ou comprimento de onda) para corpos diferentes varia. Por exemplo, um corpo com superfície muito negra irradia ondas eletromagnéticas de todas as frequências, mas a curva da dependência da energia em ordem à frequência atinge o máximo para uma determinada frequência fmax ( fig. 1) . A energia de irradiação, que corresponde a frequências infinitamente pequenas e infinitamente grandes, é insignificante. Quando aumenta a temperatura, o máximo da energia de radiação desloca-se para o lado das ondas curtas.
Os espectros contínuos, como mostra a experiência, são dados pelos corpos que se encontram no estado sólido ou líquido. Para se obter um espectro contínuo é necessário aquecer o corpo a altas temperaturas.
O caracter de um espectro contínuo e o próprio fato da sua existência é determinado não só pelas propriedades de cada um dos átomos que irradiam, mas também pela interação destes átomos uns com os outros. Os gases não têm espectros contínuos. Os líquidos e os corpos sólidos diferenciam-se dos gases, em primeiro lugar, pelo fato dos seus átomos interatuarem fortemente.
O espectro contínuo também é dado pelo plasma a altas temperaturas. as ondas eletromagnéticas são irradiadas pelo plasma quando chocam elétrons com íons.
Espectros de linhas
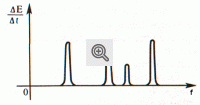
Coloquemos numa chama fraca de um bico de gás um pouco de amianto umedecido por uma solução de sal de cozinha. Quando observamos a chama através de um espectroscópio, no fundo de um espectro contínuo dificilmente visível destaca-se uma linha amarela brilhante. Esta linha amarela é nos dada pelo vapor de sódio que se forma quando as moléculas de sal se dissociam na chama. No suplemento a cores estão representados também o espectro do hidrogênio e do hélio. Cada um deles é constituído por uma série de linhas coloridas de intensidades diferentes, divididas por largas faixas escuras. Tais espectros chamam-se espectros de linhas . A existência de espectros de linhas significa que a substância analisada irradia luz com determinados comprimentos de onda (mais precisamente, determinados intervalos espectrais muito estreitos). Na figura 2 , vê-se um exemplo da distribuição da energia num espectro de linhas. Cada linha têm uma largura finita.
Os espectros de linhas são-nos dados por todas as substâncias que se encontram no estado gasoso atômico (mas não molecular). Neste caso, a luz é irradiada pelos átomos que, praticamente, não interatuam. É o tipo de espectros mais importantes.
Os átomos isolados de um dado elemento químico irradiam ondas de comprimentos rigorosamente determinados.
Em geral, para se observarem espectros de linhas, utiliza-se a luminescência de vapores em chamas ou de descargas num tubo, cheio do gás que se observa.
Quando aumenta a densidade do gás atômico, as linhas espectrais separadas alargam-se e, por fim, quando a densidade do gás é muito grande e a interação dos átomos se torna significativa, então estas linhas cobrem-se umas às outras, formando um espectro contínuo.
Espectros de faixas
Um espectro de faixas é composto por faixas separadas, divididas, por intervalos escuros. Com o auxílio de um instrumento espectral muito bom pode-se verificar que cada faixa é um conjunto de linhas situadas junto umas às outras.
Ao contrário dos espectros de linhas, os espectros de faixas são formados não por átomos, mas por moléculas isoladas ou com uma ligação fraca entre elas.
Para observação dos espectros moleculares, assim como para observação dos espectros de linhas, em geral, utiliza-se a emissão luminosa de vapor sob chamas ou de descargas em gases.
Espectros de absorção
Todas as substâncias, cujo átomos se encontram em estados excitados, irradiam ondas luminosas, cuja energia, de determinado modo, está distribuída segundo o comprimento de onda. A absorção da luz pelas substâncias também depende do comprimento de onda. Assim, o vidro vermelho deixa passar ondas que correspondem à luz vermelha ( l » 8. 10-5 cm) e absorve as outras ondas.
Se fizermos passar a luz branca através de um gás frio e não irradiante, no fundo do espectro contínuo do emissor aparecem linhas escuras. O gás absorve mais intensamente a luz que tem aquele comprimento de onda que o gás emite num estado bastante aquecido. As linhas escuras no fundo do espectro contínuo são linhas de absorção que formam no conjunto um espectro de absorção.