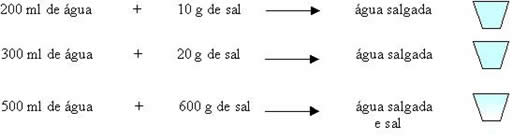
A determinação e a análise das propriedades específicas dos materiais do ambiente, são formas de se conseguir saber se uma determinada matéria é uma substância pura ou uma mistura.
Você pode separar, pequenas quantidades, de alguns materiais do meio ambiente, como sal de cozinha, fio de cobre, vinho, água salgada, água destilada e determinar algumas das propriedades específicas desses materiais, como por exemplo: densidade, ponto de fusão e ebulição. Os dados obtidos podem ser colocados em uma tabela
| Material | P.F (0C) | P.E (0C) | Densidade (g/ml) |
| amostra 1 - sal de cozinha amostra 2 - sal de cozinha |
801 801 |
1 473 1473 |
2,16 2,16 |
| amostra 1 - fio de cobre amostra 2- fio de cobre |
1 083 1 083 |
2 582 2 582 |
8,93 8,93 |
| amostra 1 - vinho amostra 2 - vinho |
- | - | 1,04 1,06 |
| amostra 1 - água salgada amostra 2 - água salgada |
- - |
- - |
1,04 1,07 |
| amostra 1 - água destilada amostra 2 - água destilada |
0 0 |
100 100 |
1,00 1,00 |
Analisando os resultados da tabela você notará que os valores dessas propriedades serão os mesmos, para qualquer quantidade que você utilizar, para o sal de cozinha, fio de cobre e água destilada..
A partir dessas determinações e análises em nível macroscópico, isto é, que se pode ver a olho nu e medir, você poderá classificá-las como substâncias puras e os outros materiais analisados que apresentavam variação de alguma das propriedades determinadas, são classificados como misturas. As misturas são formadas por duas ou mais substâncias puras e estas são chamadas de componentes da mistura.
As substâncias puras podem ser classificadas em:
Substâncias puras simples: que são formadas pela combinação de átomos de um único elemento químico, como por exemplo o gás hidrogênio formado por dois átomos de hidrogênio ligados entre si; o ozônio formado por três átomos de oxigênio.
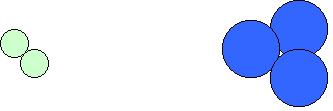
Substâncias puras compostas: que são formadas pela combinação de átomos de dois ou mais elementos químicos diferentes, como por exemplo a água formada por dois átomos de hidrogênio e um átomo de oxigênio; ácido clorídrico (nome comercial ácido de muriático) formado por um átomo de hidrogênio e um átomo de cloro.

Uma outra característica importante das substâncias puras refere-se a sua composição, que é sempre fixa e definida, por exemplo, para se formar água é necessário a combinação de dois átomos de hidrogênio e um átomo de oxigênio
A água é formada na proporção de 2 gramas de hidrogênio para 16 gramas de oxigênio.
As misturas, não possuem composição fixa e definida, por exemplo, para obter uma mistura de água e sal pode-se colocar qualquer quantidade de água e qualquer quantidade de sal.
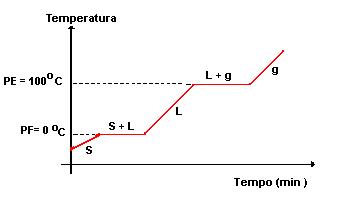
Uma das formas de diferenciação das substâncias puras e das misturas é através da temperatura, durante as mudanças de estado físico.
Você poderá analisar a água destilada, que é uma substância pura, a pressão ao nível do mar, a partir da temperatura de -5oC. Nesta temperatura a água destilada encontra-se no estado sólido. Se a água for aquecida continuamente, ao ser atingida a temperatura de 0oC, a água começará a passar para o estado líquido e a temperatura não sofrerá alteração até que a fusão se complete.
A mesma situação será verificada na mudança do estado líquido para o gasoso. Para a água destilada, a vaporização acontece a temperatura de 100oC.
Essas observações podem ser traduzidas em um gráfico, a linha horizontal que aparece no gráfico é chamada de patamar e indica a temperatura de fusão e a de vaporização da substância pura.
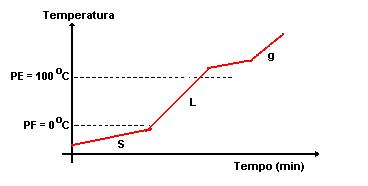
Para um mistura de água e sal, por exemplo, não se verifica o aparecimento do patamar, tanto na fusão como na ebulição, porque a temperatura não se mantém constante.
Misturas Homogêneas e Heterogêneas
A matéria encontrada na natureza, na sua grande maioria, é formada por duas ou mais substâncias puras, portanto são misturas.
Observe as misturas:
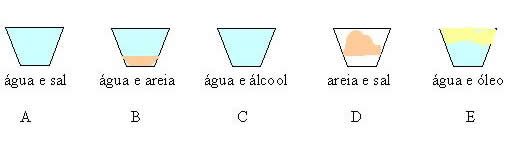
Nas misturas B, D, E observa-se uma superfície de separação entre os componentes que as formam e, por isso, recebem a denominação de misturas heterogêneas.
Nesse caso, as espécies químicas que formam a mistura são insolúveis entre si; no caso de dois líquidos, usa-se termo imiscíveis.
Nas misturas A e C não se percebe superfície de separação entre os componentes, a mistura apresenta o mesmo aspecto em toda sua extensão e recebem a denominação de misturas homogêneas. Nesse caso, as espécies químicas que formam a mistura são solúveis entre si; quando as substâncias solúveis entre si, são dois líquidos, usa-se o termo miscíveis entre si.
As misturas homogêneas são monofásicas ou unifäsicas ,isto é, possuem uma única fase e as heterogêneas polifásicas, isto é, possuem duas ou mais fases.
Recebe a denominação de fase cada porção uniforme de uma determinada matéria, com as mesmas características em toda sua extensão.
O granito, uma matéria heterogênea, constituído de três fases, isto é ,de três porções visualmente uniformes, a fase da mica (brilhante), a fase do quartzo (transparente) e a fase do feldspato.
Obtenção de substâncias puras a partir de misturasComo os materiais encontrados na natureza, na sua maioria, são constituídos de misturas de substâncias puras, por isso, para obtê-las, é necessário separá-las.
Existem muitos processos para separação de misturas, mas o método a ser empregado depende das condições materiais para utilizá-lo e do tipo de mistura a ser separado.
Você já pensou em como separar algumas misturas que são encontradas no seu cotidiano?
Para isso é necessário, em primeiro lugar, observar se a mistura em questão é homogênea ou heterogênea, para em seguida escolher o processo mais adequado para separá-la.
Os processos mais utilizados para separação de misturas são:
1) Catação, Ventilação, Levigação, Peneiração, Separação Magnética e Flotação, usados na separação de misturas heterogêneas constituídas de dois componentes sólidos.
Catação: os grãos ou fragmentos de um dos componentes são catados com as mãos ou com uma pinça.
Ventilação: passa-se pela mistura uma corrente de ar e este arrasta o mais leve.
Levigação: passa-se pela mistura uma corrente de água e esta arrasta o mais leve.
Separação magnética: passa-se pela mistura um imã, se um dos componentes possuir propriedades magnéticas, será atraído pelo imã.
Peneiração: usada quando os grãos que formam os componentes tem tamanhos diferentes.
Flotação: é um processo de separação onde estão envolvidos os três estados da matéria - sólido, líquido e gasoso. As partículas sólidas desejadas acumulam-se nas bolhas gasosas introduzidas no líquido. As bolhas têm densidade menor que a da fase líquida e migram para superfície arrastando as partículas seletivamente aderidas. O produto não desejável é retirado pela parte inferior do recipiente.
2) Decantação: usado para separar os componentes de misturas heterogêneas, constituídas de um componente sólido e outro líquido ou de dois componentes líquidos, estes líquidos devem ser imiscíveis. Esse método consiste em deixar a mistura em repouso e o componente mais denso, sob a ação da força da gravidade, formará a fase inferior e o menos denso ocupará a fase superior. Quando a mistura a ser separada é constituída de dois líquidos imiscíveis, pode se utilizar um funil de vidro, conhecido como Funil de Decantação ou Funil de Bromo. A decantação é usada nas estações de tratamento de água, para precipitar os componentes sólidos que estão misturados com a água.
3) Centrifugação: é usado para acelerar a decantação da fase mais densa de uma mistura heterogênea constituída de um componente sólido e outro líquido. Esse método consiste em submeter a mistura a um movimento de rotação intenso de tal forma que o componente mais denso se deposite no fundo do recipiente.
A manteiga é separada do leite por centrifugação. Como o leite é mais denso que a manteiga, formará a fase inferior.
Nos laboratórios de análise clínica o sangue, que é uma mistura heterogênea, é submetido a centrifugação para separação dos seus componentes.
A centrifugação é utilizada na máquina de lavar roupa, na separação da água e do tecido que constitui a roupa.
4) Filtração: é usada para separação de misturas heterogêneas, constituídas de um componente sólido e outro líquido ou de um componente sólido e outro gasoso. A mistura deve passar através de um filtro, que é constituído de um material poroso, e as partículas de maior diâmetro ficam retidas no filtro. Para um material poder ser utilizado como filtro seus poros devem ter um diâmetro muitíssimo pequeno.
A filtração é o processo de separação utilizado no aspirador de pó. O ar e a poeira são aspirados, passam pelo filtro, que é chamado saco de poeira, as partículas sólidas da poeira ficam retidas no filtro e o ar sai.
5) Evaporação: é usado para separação de misturas homogêneas constituída de um componente sólido e o outro líquido. A evaporação é usada para separar misturas, quando apenas a fase sólida é de interesse.O sal de cozinha é extraído da água do mar por evaporação. A água do mar é represada em grandes tanques, de pequena profundidade, construídos na areia, chamados de salinas. Sob a ação do sol e dos ventos a água do mar represada nas salinas sofre evaporação e o sal de cozinha e outros componentes sólidos vão se depositando no fundo dos tanques.
O sal grosso obtido nas salinas, além do uso doméstico, também é utilizado em países de inverno muito rigoroso, para derreter a neve, visto que o gelo cobre as ruas, estradas, pastagens. Isso ocorre porque ao dissolvermos uma substância em um líquido esta diminui o ponto de congelação do líquido.
6) Destilação simples: é usada para separar misturas homogêneas quando um dos componentes é sólido e o outro líquido. A destilação simples é utilizada quando há interesse nas duas fases. Este processo consiste em aquecer a mistura em uma aparelhagem apropriada, como a esquematizada abaixo, até que o líquido entre em ebulição. Como o vapor do líquido é menos denso, sairá pela parte superior do balão de destilação chegando ao condensador, que é refrigerado com água, entra em contato com as paredes frias, se condensa, voltando novamente ao estado líquido. Em seguida, é recolhido em um recipiente adequado, e o sólido permanece no balão de destilação.7) Destilação Fracionada: é usada na separação de misturas homogêneas quando os componentes da mistura são líquidos. A destilação fracionada é baseada nos diferentes pontos de ebulição dos componentes da mistura. A técnica e a aparelhagem utilizada na destilação fracionada é a mesma utilizada na destilação simples, apenas deve ser colocado um termômetro no balão de destilação, para que se possa saber o término da destilação do líquido de menor ponto de ebulição. O término da destilação do líquido de menor ponto de ebulição, ocorrerá quando a temperatura voltar a se elevar rapidamente.
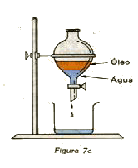
A destilação fracionada é utilizada na separação dos componentes do petróleo. O petróleo é uma substância oleosa, menos densa que a água, formado por uma mistura de substâncias. O petróleo bruto é extraído do subsolo da crosta terrestre e pode estar misturado com água salgada, areia e argila. Por decantação separa-se a água salgada, por filtração a areia e a argila. Após este tratamento, o petróleo, é submetido a um fracionamento para separação de seus componentes, por destilação fracionada. As principais frações obtidas na destilação do petróleo são: fração gasosa, na qual se encontra o gás de cozinha; fração da gasolina e da benzina; fração do óleo diesel e óleos lubrificantes, e resíduos como a vaselina, asfalto e pixe.
A destilação fracionada também é utilizada na separação dos componentes de uma mistura gasosa. Primeiro, a mistura gasosa deve ser liquefeita através da diminuição da temperatura e aumento da pressão. Após a liquefação, submete-se a mistura a uma destilação fracionada: o gás de menor ponto de ebulição volta para o estado gasoso. Esse processo é utilizado para separação do oxigênio do ar atmosférico, que é constituído de aproximadamente 79% de nitrogênio e 20% de oxigênio e 1% de outros gases. No caso desta mistura o gás de menor ponto de ebulição é o nitrogênio.
Para produção de objetos, ornamentos, utensílios domésticos muitas vezes é necessário separar os componentes de um mistura para obtenção das substâncias puras, mas outras vezes é necessário fazermos misturas de substâncias para obtermos alguns materiais. Quando nessas misturas um dos componentes é um metal forma-se um liga metálica. As ligas metálicas apresentam características diferentes dos metais puros e por isso podem ser utilizadas com maior vantagem em relação ao metal puro. As ligas de cobre e cromo são usadas em resistências elétricas como a de chuveiro porque ocorre a diminuição da condutividade elétrica, em outras ligas ocorre o aumento da resistência mecânica, a resistência a corrosão, a ductibilidade etc.
| Liga metálica | Componentes | Característica | Uso |
| Latão | Cobre e Zinco | resistente à corrosão | navios, tubos |
| Bronze | Cobre e Estanho | resistente à corrosão | moedas, sinos |
| Aço | Ferro e carbono | resistente à corrosão | navios, utensílios domésticos |
| Aço inoxidável | Aço e Cromo | resistente à corrosão | talheres, utensílios domésticos |
| Aço -Níquel | Aço e Níquel | resistência mecânica | canhões, material de blindagem |
| Aço-Tungstênio | Aço e Tungstênio | alta dureza | brocas, pontas de caneta |
| Alnico | Aço, alumínio, níquel e cobalto | propriedades magnéticas | fabricação de imãs |
| Amálgama | Mercúrio, prata e estanho | restauração de dentes | |
| Ouro 18 quilates | Ouro e cobre | alta ductibilidade e maleabilidade | jóias |
| Prata de lei | Prata e cobre | aumento da dureza | utensílios domésticos, ornamentos |
| Electron Liga de magnésio | Mg, alumínio, manganês, zinco | resistência mecânica e térmica | peças muito leves |
Reciclagem
A maioria dos materiais utilizados na produção de objetos e que após o uso são jogados no lixo, podem ser reaproveitados, e esse processo é conhecido como reciclagem.
A reciclagem é importante porque alguns materiais não são biodegradáveis, isto é, não são decompostos por microorganismos, causando grande poluição ambiental. Além disso, a grande maioria desses materiais é retirada de reservas minerais não renováveis, diminuindo assim os recursos naturais da Terra..
Grande parte do lixo doméstico pode ser reciclado. Quase todo lixo produzido pelos seres vivos, exceto o homem, sofre um reciclagem natural, são decompostos por microorganismos. Muitos materiais utilizados na produção de objetos, embalagem para produtos alimentícios e de consumo como: embalagem plástica, vidro, latas de óleo, cerveja, refrigerantes não se decompõe naturalmente ou levam muitos anos para que isso aconteça e nesses casos podem e devem ser reciclados. O maior problema da reciclagem é a separação dos materiais reaproveitáveis como papel, vidro, plástico e metais.
As indústrias também são responsáveis pela poluição ambiental e produtoras de lixo. Algumas indústrias estão desenvolvendo técnicas para reaproveitamento do seu lixo
Os plásticos não se decompõem facilmente, mas é difícil sua separação para reciclagem e a maior parte é queimada ou enterrada com o resto do lixo. Garrafas plásticas de bebidas derretem facilmente ao serem aquecidas e podem ser remodeladas produzindo outros produtos.
O papel é facilmente reciclável e esta deve ser estimulada porque para a produção de papel consome-se milhões de árvores, e, além disso, extensas áreas de mata nativa são desmatadas para o plantio de árvores usadas na fabricação do papel. As embalagem usadas para leite longa vida, creme de leite, leite condensado, extratos de tomate e outras, não podem ser recicladas, porque além de papelão, internamente existe uma película bem fina de alumínio e plástico, consequentemente, quando há uma mistura não é possível a reciclagem. Alguns desses materiais não recicláveis podem ser reutilizados.
O problema do lixo só será minimizado quando houver um redução na produção de lixo, através de campanhas educativas; reaproveitamento de materiais e reciclagem.
O que se descarta sem maior preocupação, todos os dias, em qualquer lugar, só não deixa a Terra soterrada de dejetos, graças as bactérias, fungos, leveduras e outros microorganismos. Esses se alimentam da matéria orgânica do lixo, transformando os compostos mais complexos em compostos mais simples que são devolvidos ao meio ambiente.
O tempo de decomposição depende do tipo de lixo e de outros fatores, como o calor e a umidade do solo que tornam a decomposição mais rápida, por outro lado, terrenos ácidos e águas limitam a capacidade de desenvolvimento dos microorganismos, tornando a biodegradação muito lenta. Os ácidos, as substâncias tóxicas e os metais pesados, como por exemplo, o chumbo, prejudicam os microorganismos, podendo até matá-los.
Tempo de decomposição de alguns materiais
Material Tempo de decomposição
| papel | 3 meses em lugar úmido, jornais podem permanecer por décadas sem sofrer decomposição. |
| palito | 6 meses em lugar úmido. |
| iltro de cigarro | de 1 a 2 anos, quando jogado no campo a decomposição é mais rápida, em torno de 4 meses; no asfalto é muito mais lenta. |
| chiclete | 5 anos |
| metais | em princípio, não são biodegradáveis. Uma lata de aço demora 10 anos se oxidar, já a lata de alumínio não se corrói nunca. |
| plásticos | mais de 100 anos, como o plástico existe apenas a um século, não é possível determinar seu grau de biodegradação. |
| vidro | não sofrerá biodegradação nunca. Por ser formado de areia, carbonato de sódio, cal e outras substâncias inorgânicas, os microorganismos não conseguem comê-lo. Um objeto de vidro demoraria 4 000 anos para se decompor pela erosão e ação de agentes químicos. |
Fonte:
http://educar.sc.usp.br/ciencias/quimica/qm1-2.htm